2020年11月26日-29日中华医学会第十四次全国生殖医学学术会议在珠海国际会展中心举办,此次会议主题为“携手共创新生命”。
国内唯一“有证”三代试管PGS试剂盒亮相中华医学会生殖年会
本次大会国内辅助生殖领域龙头企业苏州贝康医疗器械有限公司携国内首个“有证”三代试管PGS产品亮相会议现场。该产品可针对胚胎进行植入前染色体筛查,从而大幅提高试管婴儿临床妊娠率,降低流产率,也是目前唯一能够实现胚胎全染色体精准筛查的Ⅲ类医疗器械注册产品。

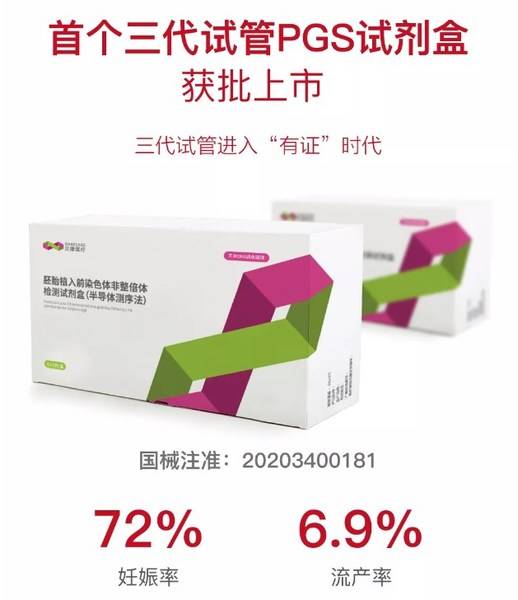
从2016年开始,历经4年时间,经过3万多例胚胎临床样本的PGS检测,数据统计显示,PGS试剂盒将试管婴儿临床妊娠率由原来的46%提高至72%,流产率由33%降低到6.9%。该检测试剂盒也于今年获得了行业内首个医疗器械注册证(国械注准:20203400181),填补了我国三代试管临床应用的技术空白,标志着三代试管PGS检测正式进入“有证”时代。

医患纠纷频繁的今天,使用无证医疗器械,如履薄冰
2014年3月,国家药监局发布的《医疗器械监督管理条例》(以下简称《条例》)第四十条明确规定,“医疗器械、使用单位不得经营、使用未依法注册的医疗器械”,第六十三条、第六十六条明确规定“对于经营和使用未注册医疗器械的处罚条款”。同时,国家药监局还发文表示,将切实加强医疗器械使用监管,进一步规范生产、经营和使用秩序,严厉打击生产、经营和使用无注册证体外诊断试剂行为,保障患者用械安全、有效。使用无证医疗器械产品,不但有损患者利益,对医院自身也带来极高的违法成本。
三代试管婴儿检测产品属于最高级别的医疗器械,院内及外送检测须谨慎
2014年2月,国家药监局和卫健委联合发布《关于加强临床使用基因测序相关产品和技术管理通知》,明确了基因测序诊断产品属于医疗器械,基因测序需要应用的检测仪器、诊断试剂和相关医用软件等产品,需要经过国家药监部门审批注册,并经卫生计生行政部门批准技术准入。PGS试剂盒属于III类医疗器械,按照国家医疗器械相关法律强制性规定,任何医疗机构(包括医院、医学检验所、医学检验中心等)在开展临床应用项目时,均应当使用有注册证的医疗器械,产品开发依托的平台也必须获得三类医疗器械注册证。
自PGS试剂盒获批上市后,国家药品监督管理局紧接着发布公告,2020年8月1日起,PGS试剂盒被纳入强制性医药行业标准。《条例》第六条规定“医疗器械产品应当符合医疗器械强制性国家标准;尚无强制性国家标准的,应当符合医疗器械强制性行业标准”。各有关单位要充分认识强制性行业标准的法律地位,切实维护强制性行业标准的权威性,确保强制性行业标准规范、有效实施。
展望
据弗若斯特沙利文的调研资料显示,中国辅助生殖市场规模大约1000亿元,三代试管婴儿的市场由2015年约3亿元增加至2019年的25亿元,复合增长率达到70.8%,预计2024年达到250亿元。三代试管婴儿的创新技术给不孕不育夫妇提供了新的选择,为携带遗传性疾病的备孕夫妇带来了新的希望,三代试管PGS试剂盒将成为临床的刚需。正是由于市场的不断发展,医疗器械的经营和使用也面临越来越严格的法律规范要求及合规挑战,未来有证医疗器械的使用也是必然的发展趋势。医疗机构及医务人员也应加强医疗安全意识和风险防范意识,合法合规使用药械,避免因使用无证产品带来的各种风险。
 关注
关注
 中国企业新闻网
中国企业新闻网

 2020-11-26 18:06
2020-11-26 18:06



